Parthenogenetisch onbevruchte menselijke eicellen vallen niet onder begrip 'menselijke embryo'
Conclusie A-G HvJ EU 17 juli 2014, IEFbe 932, zaak C-364/13 (International Stem Cell Corporation tegen Comptroller General of Patents) - dossier - persbericht
)
De A-G concludeert: onbevruchte menselijke eicellen die worden gestimuleerd tot deling en verdere ontwikkeling door middel van parthenogenese vallen niet onder het begrip „menselijke embryo’s” van artikel 6, lid 2, sub c, van richtlijn 98/44/EG richtlijn van het Europees Parlement en de Raad van 6 juli 1998 betreffende de rechtsbescherming van biotechnologische uitvindingen, zolang zij niet het vermogen hebben om zich tot een mens te ontwikkelen en niet genetisch zijn gemanipuleerd om dat vermogen te verkrijgen.
Gestelde vraag:
„Vallen onbevruchte menselijke eicellen, die werden gestimuleerd tot deling en verdere ontwikkeling middels parthenogenese, en die anders dan bevruchte eicellen enkel pluripotente cellen bevatten en zich niet kunnen ontwikkelen tot menselijke wezens, onder de term „menselijke embryo’s” bedoeld in artikel 6, lid 2, sub c, van richtlijn 98/44/EG betreffende de rechtsbescherming van biotechnologische uitvindingen?”
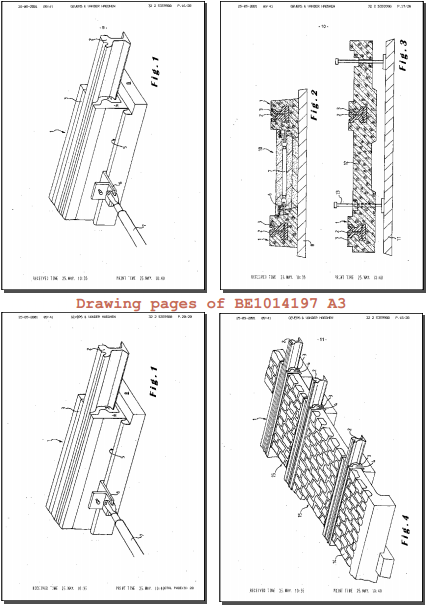 Droit des brevets. Code judiciaire. Prefarails est une société spécialisée dans la fabrication et le placement de voies ferrées pour les trams. Elle a développé une technologie brevetée pour isoler la voie des courants électriques vagabonds. La SA FERONIA est ou était titulaire de (quatre) brevets utilisés par Prefarails. Le Tribunal de commerce de Mons se déclare incompétent pour connaître de l’action en concurrence déloyale et dit la demande principale est non fondée. La cour va procéder à un examen de chaque brevet et en conclut que la preuve de la contrefaçon n'est toujours pas rapportée et que le jugement dont appel doit être confirmé. A défaut de contrefaçon, les autres développements juridiques ne doivent plus être examinés. La Cour confirme le jugement dont appel, dans ses dispositios entreprises. La Cour condamne Prefarails c.s. aux dépens de l'appel, étant l'indemnité de procédure liquidée à la somme de €11.000.
Droit des brevets. Code judiciaire. Prefarails est une société spécialisée dans la fabrication et le placement de voies ferrées pour les trams. Elle a développé une technologie brevetée pour isoler la voie des courants électriques vagabonds. La SA FERONIA est ou était titulaire de (quatre) brevets utilisés par Prefarails. Le Tribunal de commerce de Mons se déclare incompétent pour connaître de l’action en concurrence déloyale et dit la demande principale est non fondée. La cour va procéder à un examen de chaque brevet et en conclut que la preuve de la contrefaçon n'est toujours pas rapportée et que le jugement dont appel doit être confirmé. A défaut de contrefaçon, les autres développements juridiques ne doivent plus être examinés. La Cour confirme le jugement dont appel, dans ses dispositios entreprises. La Cour condamne Prefarails c.s. aux dépens de l'appel, étant l'indemnité de procédure liquidée à la somme de €11.000. Uitspraak ingezonden door Bruno Vandermeulen,
Uitspraak ingezonden door Bruno Vandermeulen, %20-%20Hand%20garden%20tool%20for%20digging%20and%20cleaning%20small%20ditches%20BE%20depot%2009800289.png) Droit de brevet. L’appelant en tant qu’inventeur d’un outil de jardin, appelé "le rigolet", a obtenu
Droit de brevet. L’appelant en tant qu’inventeur d’un outil de jardin, appelé "le rigolet", a obtenu  Since the last information provided to the Competitiveness Council at its meeting of December 2013, the Select Committee has:
Since the last information provided to the Competitiveness Council at its meeting of December 2013, the Select Committee has:  Zie prejudicieel verzoek
Zie prejudicieel verzoek  Décision envoyée par Renaud Dupont,
Décision envoyée par Renaud Dupont,  Uitspraak ingezonden door Steven Cattoor,
Uitspraak ingezonden door Steven Cattoor,  Uitspraak ingezonden door Fernand De Visscher en Tineke Van Hoey,
Uitspraak ingezonden door Fernand De Visscher en Tineke Van Hoey,  Als randvermelding. REACH - octrooi - samengestelde voorwerpen. Verordening (EG) nr. 1907/2006 van het Europees Parlement en de Raad van 18 december 2006 inzake de registratie en beoordeling van en de autorisatie en beperkingen ten aanzien van chemische stoffen (REACH). Een verwijzingsbeschikking van vier pagina’s en een korte vraag. Er zijn al vaak vragen over de begrippen samengesteld versus bestanddelen gesteld in het kader van octrooien. Nu dan in verband met de chemische samenstelling van een voorwerp.
Als randvermelding. REACH - octrooi - samengestelde voorwerpen. Verordening (EG) nr. 1907/2006 van het Europees Parlement en de Raad van 18 december 2006 inzake de registratie en beoordeling van en de autorisatie en beperkingen ten aanzien van chemische stoffen (REACH). Een verwijzingsbeschikking van vier pagina’s en een korte vraag. Er zijn al vaak vragen over de begrippen samengesteld versus bestanddelen gesteld in het kader van octrooien. Nu dan in verband met de chemische samenstelling van een voorwerp.






















